Cours Transformations spontanées dans les piles et production d'énergie pdf ppt
Transformations spontanées dans les piles et production d'énergie, cours avec exercices corrigés, pours 2bac PC et SM et SVT.
.jpg) |
| Transformations spontanées dans les piles et production d'énergie |
Bonjours, les éléves 2éme année bac international option francais, sciences physique (2bac pc). Ansi les éléves bac sciences maths et sciences de la vie et de terre. Ajourd'hui, de ce chapitre qui concerne le cours des piles et la prodution d'énergie, à partir des reactions oxydo-reductions. Nous avons vu au chapitre 7,du programme chimie bac, qu’un système chimique peut évoluer spontanément vers un état d’équilibre. (voir Évolution spontanée d'un système chimique)
Est-il possible lors de cette évolution spontanée de récupérer de l’énergie ?
- Transferts spontanés d’électrons dans une pile;
- Constitution d’une pile;
- ET comment Fonctionne la pile Daniell;
- Rôle du pont salin;
- Représentation conventionnelle de la pile;
- Ansi comment calculer la quantité d'électricité maximale débitée par une pile;
- Exemples des piles usuelles.
Transformations spontanées dans les piles et production d'énergie Exercices corrigés.
une partie du cours
Transfert d'électrons dans une pile:
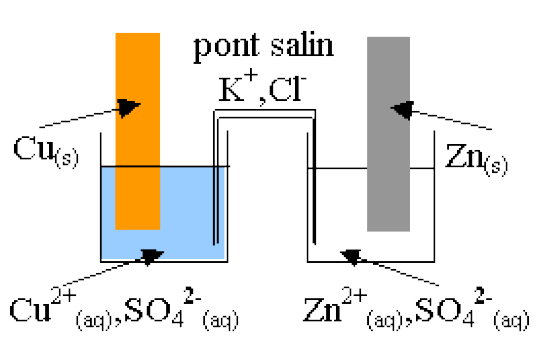
Dans le cours précédent, on a constaté que le transfert spontané et direct d'électrons du réducteur vers l'oxydant est possible.Si on sépare les espèces chimiques, on peut réaliser un transfert spontané et indirect du réducteur vers l'oxydant en les reliant par un conducteur métallique. C'est le principe d'une pile.
Constitution d'une pile électrochimique :exercices
- Définition :Pile électrochimique.
- Description :
👉 Un pont salin ou une paroi poreuse reliant les 2 demi-piles.
💥 Chaque demi-pile est composée des espèces d'un couple oxydant/réducteur. Souvent le couple est formé d'un ion métallique Mn+ et du métal M. L'électrode alors constituée du métal M. Dans certains cas, l'électrode est constituée d'un matériau conducteur inerte. L'oxydant et le réducteur du couple sont alors dans la solution.
💥 Le pont salin est constitué d'un tube en U creux rempli d'une solution gélifiée conductrice concentrée (ou d'une simple feuille de papier imbibé d'une solution conductrice).
- La pile Leclanché ou pile saline :
💣 L'électrolyte est une solution acide gélifiée de chlorured'ammonium NH4+ + Cl-.
💣 Le pôle positif est un bâton de graphite (carbone). C'est uneélectrode inerte en contact avec du dioxyde de manganèse, oxydant du couple MnO2 / MnO(OH).
💣 Le graphite en poudre assurent une meilleure conduction.
 |
| Les piles AlloSchool exercices corriges 2bac |
- Demi-équations :
MnO2 (s) + H+(aq) + e- ⇌MnO(OH)(s)
La force électromotrice proche de 1,5 V. Le réactif en défaut est le dioxyde de manganèse.
Cette pile est dite "sèche" car elle ne contient pas de liquide mais un gel évitant à la pile de couler.
L'électrolyte de la paroi poreuse est un sel, pour cette raison, la pile est dite "pile saline".
Dans d'autres piles dites "piles alcalines", l'électrolyte est basique (alcalin), par exemple une solution gélifiée d'hydroxyde de potassium (K+ + HO-).
Les piles bouton plus énergétiques sont à l'oxyde d'argent :(-) Zn / ZnO // Ag2O / Ag / C (+).
إرسال تعليق